丂丂丂丂丂丂丂丂丂丂丂丂宯摑暘愅 偺幚尡丂乮侾乯
丂丂梲僀僆儞偺掕惈暘愅偺拞偱丄揱摑揑偵峴傢傟偰偒偨 宯摑暘愅傪峴側偄傑偡丅 尦慺暘愅偺庤朄偼丄尨巕媧岝傗 ICP 丄寀岝X慄側偳偺婡婍暘愅偑庡棳偲側偭偰偄偰丄宯摑暘愅偺幚梡壙抣偼壓偑偭偰偄傑偡丅 偟偐偟丄暔幙偺捑揳摿惈傗 倫H偺曄壔偵傛傞怳傞晳偄傪懱摼偟丄埨壙偱娙曋偵應掕偟丄傑偨嬥懏傗柍婡壔惉昳惢憿偺巜恓傪摼偰丄壔妛偺婎杮揑斀墳丄暘棧偺巇慻傒丄婎杮揑側幚尡憖嶌傪廗摼偡傞偵偼丄偙偺幖幃暘愅偑堦斣偲巚傢傟傑偡丅
丂丂宯摑暘愅偵偼偄偔偮偐偺僷僞乕儞偑偁傝丄偙偙偱偼嵟傕堦斒揑側丄棸壔暔傪拞怱偵暘懏偡傞曽朄丄亖乽棸壔暔朄乿傪丄側傞傋偔乽僙儈丒儈僋儘乿偺婯柾偱峴側偆傕偺偲偟傑偡丅乮梕検侾揌亖栺侽丏侽俆倣倢丅丂傕偪傠傫悈偼偡傋偰乽扙僀僆儞悈乿傪巊偆丅丂僗億僀僩偼億儕侾倣倢偺傕偺偱丄侽丏侾倣倢崗傒偺栚惙桳傝偱戙梡壜丅乯
丂丂側偍丄嵟嬤偱偼丄偙偺棸壔悈慺偺埆廘偲撆惈傪寵偭偰丄乽僠僆傾僙僩傾儈僪乮CH3丒C=S丒NH2乯乿偱戙懼偡傞傛偆偵側偭偰偒偰偄傑偡丅 偨偩偟 僠僆傾僙僩傾儈僪偑棸壔悈慺傪弌偡懍搙丄偡側傢偪棸壔暔宍惉偺懍搙偼抶偔乮搾梺偱壛壏偡傞忋丄姰寢偵侾侽暘傕偐偐傞乯丄傑偨梀棧偺棸墿偑弌傗偡偔 捑揳偺尒暘偗曽偵偼弉楙偑昁梫偱偡丅
丂丂丂丂丒丒丒丒丂巊梡偡傞棸壔悈慺偼廘偔丄偐偮桳撆側偺偱丄慡斒偵傢偨偭偰 姺婥拲堄両 拞撆偺傎偐丄乭堎廘憶摦乭偑婲偙傜側偄傛偆偵丄摿暿偺拲堄傪梫偟傑偡乮丠乯丅 摿偵丄棸壔悈慺傪娫堘偭偰傾僙僩儞偵掅壏偱悂偒崬傓偲丄悽奅嵟嫮偺埆廘暔幙乭僠僆傾僙僩儞乭偑偱偒偰偟傑偆偺偱梫拲堄丅
丂丂丂丂丂丂丂丂嶲峫HP丂嬥懏僀僆儞偺宯摑暘愅丂丂丂丂丂丂宯摑暘愅僼儘乕
丂丂侾丏丂暘愅帋栻丒梡嬶偺惍旛丗
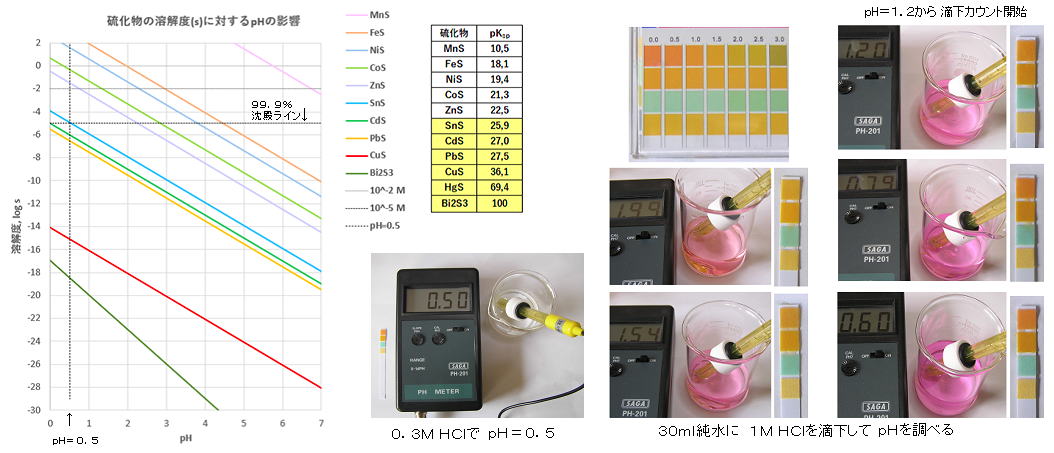
丂丂乮侾乯丂棸壔暔捑揳偺 倫H偺塭嬁丗
丂丂戞俀懏偺朻摢偱丄墫巁 HC倢 傪壛偊偰 倫俫傪 栺侽丏俇偵挷惍偟丄棸壔悈慺傪捠偠傞偲丄戞俀懏偺 俠倓2亄丄俹倐2亄丄俠倳2亄丄俫倗2亄側偳偼 俠倓俽丄俹倐俽丄俠倳俽丄俫倗俽側偳偺捑揳傪嶌傞偑丄戞係懏偺 倅値2亄丄俶倝2亄側偳偼梟塼偵巆傞丅 侽丏侽侾俵偺嬥懏僀僆儞偵偮偄偰丄梟夝搙偑 侾侽亅5 埲壓側傜偽 俋俋丏俋亾埲忋乮亖掕検揑偵乯捑揳偡傞偺偱丄倫俫亖侽丏俆偵偍偄偰棸壔悈慺傪捠偠傞偲丄戞俀懏偺偆偪嵟傕梟夝搙偺崅偄 俽値俽丄C倓俽偼廫暘捑揳偟丄堦曽 戞係懏偺偆偪嵟傕掅偄 倅値俽偼 梟夝搙偑侾侽亅2 埲忋偱偁傝 Zn2亄偼梟塼偵廫暘偲偳傑傞偙偲偵側傞丅
丂丂仠丂倫俫亖侽丏俆偲偼丄侽丏俁俵偺墫巁偺擹搙偱丄峑惓嵪傒偺倫俫儊乕僞偱應偭偰 偪傚偆偳偙偺抣偩偭偨丅
丂丂仠丂傑偨丄巜帵栻偺儊僠儖僶僀僆儗僢僩乮曄怓堟丗 侽丏俉亅俀丏俇乯偑庤帩偪偱柍偐偭偨偺偱丄僠儌乕儖僽儖乕乮曄怓堟丗 侾丏俀亅俀丏俉乯傪梡偄偰丄俁侽倣倢偺弮悈偵 侾M 乮亖侾N乯墫巁傪揌壓偟丄怓偑僺儞僋愒怓偱墿怓偑姰慡偵徚偊偨帪揰乮倫俫亖侾丏俀乯偐傜悢偊偰 侾侽侽揌慜屻偱 倫俫亖侽丏俇乣侽丏俈偵側傞偙偲偑暘偐偭偨丅乮侾倣倢僾儔丒僗億僀僩偱丄俇侽揌偱倫俫亖侽丏俉丄侾俁侽揌偱倫H亖侽丏俇丄俀侾侽揌偱倫俫亖侽丏俆丄偙偺帪係俁倣倢乯丂偦偙偱丄帋塼偺検偵墳偠偰 侾M墫巁傪揔媂壛偊傞偙偲偵偟偨丅 乮僠儌乕儖僽儖乕偑曄怓偟偒偭偨偲偙傠偐傜丄帋塼検偑侾倣倢側傜偽係乣俆揌丄 俁倣倢側傜偽侾俀乣侾俆揌 側偳乯
丂丂仠丂棸壔悈慺偽偭婥憰抲丗
丂丂丂侾乯丂棸壔揝傪嶌傞丗丂揝暡 Fe 係俆倗偲 棸墿 俽乮暡枛乯 俀俇倗傪丄擕敨偱傛偔偡傝偮傇偟偰崿偤傞丅 偙傟傪 傾儖儈僷儞傗僾儕儞宆側偳偺嬥懏惢偺梕婍偵擖傟丄僪儔僼僩偁傞偄偼屗奜偱丄傾儖儈敁偱傆偨傪偟 壓偐傜壛擬偟偰揰壩偟丄壩傪墦偞偗偰帺慠擱從偝偣傞乮庛偔愒擬偡傞乯丅 斀墳偑廔傢傝 椻偊偰偐傜丄傾僀僗僺僢僋丄僪儔僀僶乕摍偱偮偮偄偰棸壔揝 俥倕俽傪庢傝弌偟丄擕敨偵擖傟偰僓僋僓僋偵慹偔嵱偔丅丂廂検丗 栺俇侽倗丂丂丒丒丒丒丒丂拞擇偺棟壢幚尡偩乮丠乯
丂丂丂俀乯丂擇屢帋尡娗乮棸壔悈慺傪懡偔敪惗偝偣側偄偨傔乯偺嫹偄曽乮偔傃傟偰偄傞曽乯偵棸壔揝傪 俆乣侾侽倗乮俫2俽朞榓梟塼摍偺嶌惉帪偼 栺俀侽倗乯擖傟丄斀懳懁偺僗僩儗乕僩偺曽偵 侾丗侾乮俇M乯墫巁傪崿偠傜側偄傛偆偵擖傟偰丄乮怳傞偨傔乯挿傔偺僔儕僐儞娗偱偮側偓丄偽偭婥梡帋尡娗乮傗傗戝偒傔偺乯傪捠偟偰丄嵟屻偼 壓偵彫儘乕僩傪媡偝偵擖傟偰傾儖儈僫慇堐側偳傪晘偒丄偦偺忋偵徚愇奃偲悈巁壔僫僩儕僂儉傪愊憌偟偨廤婥傃傫偵摫偄偰丄梋偭偨棸壔悈慺傪僩儔僢僾偡傞丅乮捠婥掞峈偑側偄傛偆偵拲堄乯丂偙偺憰抲偼丄屗奜丄僪儔僼僩丄偁傞偄偼攔婥僟僋僩偺偮偄偨彫幒撪摍偱 拲堄怺偔巊梡偡傞丅
丂丂捠婥帪偼丄擇屢帋尡娗傪孹偗偰 墫巁傪彮偟偢偮棸壔揝懁偵擖傟丄帋椏傪擖傟偨懢帋尡娗傪帩偪丄惷偐偵怳偭偰敇婥偡傞傛偆偵偡傞丅丂乮帋椏傪岎姺丄憰抲傪偽傜偡帪側偳丄偳偆偟偰傕懡彮偺棸壔悈慺偑楻傟傞丅乯丂姺婥拲堄
丂丂

丂丂乮俀乯丂奺庬帋尡栻偺嶌惉丗
丂丂侾乯丂棸壔悈慺偽偭婥塼丗丂丂丂丒丒丒丂悈偵棸壔悈慺傪捠偟偰朞榓偟偨帪偺擹搙偼丄倫H偵傛傜偢栺侽丏侾M丅姺婥拲堄
丂丂丒丂侽丏侾M丂HCl丒H2S 朞榓塼丂丒丒丒丒丂侽丏侾俵 俫俠倢 俀侽倣倢偵 俫2俽傪夁忚偵捠偡丄丂俁侽倣倢俹俹價儞偵枾愷曐懚丂丒丒丒丂戞俀懏偺捑揳愻忩梡
丂丂丒丂侽丏侾M丂NH4NO3丒H2S 朞榓塼丂丒丒丒丒丂侽丏侾M丂NH4NO3 侽丏係倗/俆侽倣倢 傪嶌傝丄偦偺俀侽倣倢偵 俫2俽傪夁忚偵捠偡丄NH4NO3偼捑揳偺僐儘僀僪壔傪杊偖丄丂俁侽倣倢俹俹價儞偵枾愷曐懚丂丒丒丒丂戞俀懏A偺捑揳愻忩梡
丂丂丒丂侽丏俆M丂乮NH4)2S丂丒丒丒丒丂M亖俉侽丏侽丄丂侾俵丂俶俫3丂傪侾侽倣倢庢傝丄俫2俽偽偭婥 乮嵟弶 朅偑彫偝偔側傝丄朞榓偡傞偲朅偑偦偺傑傑偺戝偒偝乯丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂N倝S丄CoS捑揳梡
丂丂俀乯丂巜帵栻丗
丂丂丒丂侽丏俀亾丂僠儌乕儖僽儖乕悈梟塼 乮倫俫丗侾丏俀乮僺儞僋愒乯亅俀丏俉乮墿怓乯丄俉丏侽亅俋丏俇乮惵乯丄 儊僠儖僶僀僆儗僢僩偺戙梡乯丄丂侾侽倣倢億儕丒揌壓價儞偵曐懚
丂丂丒丂侽丏侾亾丂僼僃僲乕儖儗僢僪悈梟塼乮傠夁偡傞乯 乮俇丏俉乮墿怓)亅俉丏係乮愒乯乯丄丂侾侽倣倢億儕揌壓價儞偵曐懚
丂丂丒丂侾亾丂僼僃僲乕儖僼僞儗僀儞 俉侽亾僄僞僲乕儖梟塼 乮俉丏俁乮柍怓乯亅侾侽丏侽乮愒乯乯丄丂侾侽倣倢億儕揌壓價儞偵曐懚
丂丂俁乯丂巁丒傾儖僇儕摍丗
丂丂丒丂擹俶俫3丂俀俉亾 亖 侾俆俵
丂丂丒丂俇俵丂俶俫3丂擹俶俫3 係侾倣倢亄悈偱侾侽侽倣倢丄丂侾侽侽倣倢億儕價儞偵曐懚
丂丂丒丂俇俵丂NaOH丄丂侾侽侽倣倢億儕價儞
丂丂丒丂俇俵丂俫俠倢丂侾丗侾丄丂侾侽侽倣倢億儕價儞
丂丂丒丂侾俵丂俫俠倢丂丄丂侾侽侽倣倢億儕價儞
丂丂丒丂侽丏侾M丂俫俠倢丄丂侾侽侽倣倢億儕價儞
丂丂丒丂俇俵丂俫NO3丄丂侾侽侽倣倢億儕價儞
丂丂丒丂俁俵丂俫2俽O4丄丂侾侽侽倣倢億儕價儞
丂丂丒丂俇俵丂恷巁乮俠俫3俠俷俷俫乯丂昘恷巁乮侾俈俵乯侾侽倣倢 亄 悈偱俀俉倣倢丄丂俁侽倣倢俹俹價儞偵曐懚
丂丂丒丂俁亾丂俫2俷2丂俁侽亾俫2俷2丂俀倣倢 亄 悈偱俀侽倣倢丄丂侾侽侽倣倢億儕價儞曐懚丂丒丒丒丂戞俁懏丂僋儘儉巁傊巁壔
丂丂係乯丂奺庬帋尡塼丗
丂丂丒丂侽丏侾俵丂俲4俥倕乮俠俶乯6乮僼僃儘僔傾儞壔僇儕僂儉乯丂侽丏係倗/侾侽倣倢丂丂丂丂丂丂丒丒丒丒丂庛巁惈偱丂俠倳2亄丄Fe3亄妋擣梡
丂丂丒丂侽丏侾俵丂俲2Cr俷4丂侽丏俀倗/侾侽倣倢丄丂丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丂丂丒丒丒丂俹倐2亄丄Ba2亄妋擣梡
丂丂丒丂侾M丂俲俠俶丂侽丏俇俆倗/侾侽倣倢丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂俠倓妋擣帪偺 俠倳俽偺捑揳杊巭梡
丂丂丒丂侾M丂NH3I 丂NH3乮侾M乯侾侽倣倢偵 H I 傪捠婥丄 H I 偼擇屢帋尡娗偺曅曽偵 I2 係倗丄悈侾丏俆倣倢擖傟丄傕偆堦曽偵 愒椨乮P乯俀倗傪擖傟偰 敪惗丄乮H2S偲堘偭偰丄僈僗偺梟夝懍搙偑懍偄偺偱丄娗偺搑拞偵僺儞僠僐僢僋晅偒偺T帤娗傪愝偗丄媡棳偵慺憗偔懳墳偡傞乯丄巁夁忚偵側偭偰偄傞偺偱侾M NH3偱拞榓丄丂丂俁侽倣倢億儕價儞偵曐懚丂丒丒丒丂俙倱(嘪)傪俙倱(嘨)偵娨尦丄Hg偺妋擣梡
丂丂乮丒丂俶倎2俽倶 乮懡棸壔僫僩儕僂儉乯悈梟塼丂丒丒丒丂戞俀懏俛偺梟夝梡乮僠僆嶖僀僆儞傪嶌偭偰梟夝乯丂丂傕偟 (NH4)2俽倶 傪梡偄傟偽丄俫倗俽 偼梟偗偢 Hg2亄偼戞俀懏俙偵擖傞丅乯
丂丂丒丂俆亾丂俶倎俠倢俷丂僽儕乕僠傪偦偺傑傑巊梡丄巁壔嵻
丂丂丒丂俆亾丂俽値俠倢2丒俀H2O丂悈梟塼丄俇M墫巁傪悢揌壛偊傞丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂俛倝3亄丄俫倗2亄妋擣梡
丂丂丒丂侽丏俀M乮栺俆亾乯丂俫倗俠倢2丂悈梟塼丄俇M墫巁傪悢揌壛偊傞丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂俽値2亄妋擣梡
丂丂丒丂儅僌僱僔傾崿塼丂Mg(NO3)2 亄 NH4NO3 亄 NH3 奺侽丏俆M丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂AsO4亅妋擣梡
丂丂丒丂侽丏俆M乮栺俋亾乯 儌儕僽僨儞巁傾儞儌僯僂儉 悈梟塼丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂AsO4亅妋擣梡
丂丂丒丂俆亾丂墫巁僸僪儘僉僔儖傾儈儞丂侽丏俆倗/侾侽倣倢悈丄丂丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂揝丄儅儞僈儞娨尦梡
丂丂丒丂朞榓廘慺悈乮Br乯丂廘壔僇儕乮KB倰乯偲 夁棸巁傾儞儌儞乮乮俶俫4)2俽2俷8乯梟塼傪擬偟偰廘慺傪忲棷丄懴栻昳惈偺偹偠岥帋尡娗偵曐懚丂丒丒丒丂戞俁懏傪亄俁壙偵巁壔
丂丂丒丂侽丏俆亾 傾儖儈僲儞丂悈梟塼丄丂拞惈乣庛傾儖僇儕惈偱 愒怓偺捑揳丄丂傾儖僇儕搚椶嬥懏偑嫟懚偡傞応崌偼 侾M 乮俶俫4乯2俠俷3傪俀揌壛偊捑揳偝偣朩奞傪側偔偡丄丂丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂Al3亄偺専弌梡丂乮Be2亄丄Ga3亄傕愒怓捑揳丄 Fe丄Cr丄Ni丄Zn 偼暿偺怓乯
丂丂丒丂侽丏侾M丂KSCN乮僠僆僔傾儞壔僇儕僂儉乯丂侾倗/侾侽侽倣倢丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂Fe3亄妋擣梡
丂丂丒丂侽丏侽俆M丂Pb乮NO3)2丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂CrO42-偺妋擣梡
丂丂丒丂侾亾丂僕儊僠儖僌儕僆僉僔儉丂僄僞僲乕儖梟塼丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂傾儞儌僯傾傾儖僇儕惈偱 Ni2亄妋擣梡 乮Pd偵傕巊偊傞乯
丂丂丒丂侽丏俆亾丂NN乚僕僄僠儖傾僯儕儞丂僄僞僲乕儖梟塼丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丒丒丒丂俲3俥倕乮俠俶乯6偲嫟偵 Zn2亄妋擣梡
丂丂丒丂侽丏侾M丂俲3俥倕乮俠俶乯6乮僼僃儕僔傾儞壔僇儕僂儉乯丂侽丏俁俁倗/侾侽倣倢丄丂侾侽倣倢億儕揌壓價儞偵曐懚
丂丂丒丂朞榓NH4Cl丂丄侾侽倣倢億儕揌壓價儞偵曐懚丂丂丒丒丒丂戞係懏 愻忩梡
丂丂丒丂侾M丂扽巁傾儞儌僯僂儉乮乮俶俫4乯2俠俷3乯丂巗斕昳扽巁傾儞儌僯僂儉俁倗/俁侽倣倢乮悈梟塼偼扽巁僈僗傪備偭偔傝敪偟偰乮俶俫4乯2俠俷3偵嬤偯偔乯丄俁侽倣倢俹俹價儞偵曐懚丂丂丒丒丒丂戞俆懏偺捑揳梡
丂丂丒丂侾M丂恷巁傾儞儌僯僂儉乮NH4Ac乯丂丄丂丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂Ba2亄暘棧梡
丂丂丒丂侽丏俀俆俵丂棸巁僸僪儔僕儞乮乮俶俫2乯2丒H2俽俷4乯丂侾倗/俁侽倣倢丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丂丂丒丒丒丂Sr2亄捑揳梡
丂丂丒丂侽丏侾亾丂僇儖僙僀儞丂俆侽倣倗傪侾倣倢偺侾俵 俲俷俫偵梟偐偟 悈傪壛偊偰俆侽倣倢偵偡傞丄侾侽倣倢億儕揌壓價儞偵曐懚丂丂丒丒丒丂巁惈丒拞惈偱偼墿怓梟塼偱寀岝傪敪偡傞偑丄傾儖僇儕惈偱偼敄愒怓偱丄寀岝偼徚幐偡傞丅偟偐偟丄Al丄C倎丄俛倎丄俠倳丄俵倗丄倅値偑偁傞偲嵞傃寀岝傪敪偡傞丅丂俠倎2亄乮Sr2亄丄Ba2亄乯妋擣偼嫮傾儖僇儕惈乮倫俫侾俁乯偱 係俋俆値倣丅嫮傾儖僇儕惈偺応崌偼丄懠偼岝傜側偄丅
丂丂俆乯丂戞俇懏丄堿僀僆儞娭學偺帋栻丗
丂丂丒丂僉儗乕僩揌掕梡帋栻堦幃丗丂侽丏侽侾M EDTA 俀Na丄丂BT乮僄儕僆僋儘儉僽儔僢僋T乯 侽丏俀亾儊僞僲乕儖梟塼丄丂NN婓庍暡枛丂摍
丂丂丒丂俆亾 垷徤巁僐僶儖僠僫僩儕僂儉乮俶倎3俠倧乮俶俷2乯6丄俵亖係侽俁丏俋係乯丄丂侾侽倣倢億儕揌壓價儞偵曐懚丂丒丒丒丂俲亄丄俶俫4亄 乮俵倗2亄丄俠倎2亄乯 捑揳梡丄丂偨偩偟 K墫偼 Na傕嫟捑偡傞偺偱 掕検偵梡偄傞偙偲偼偱偒側偄丄丂K亄擹搙鑷抣偼偐側傝崅偔 侾侽侽侽倫倫倣偱幚尡偟偨偲偙傠 偼偭偒傝捑揳偟偨丅
丂丂乮丒丂俶俫3偺専弌偵偼丄僱僗儔乕帋栻偑桳柤偱偁傞乯
丂丂丒丂侽丏俆亾儓僂慺巁僇儕僂儉亄僨儞僾儞梟塼丂丒丒丒丂SO32亅 偺専弌
丂丂丒丂俶俷2帋栻乮婛惢昳丄 僫僼僠儖僄僠儗儞僕傾儈儞朄乯丂丒丒丒丂傾僝怓慺偺尨棟傪墳梡偟偨 NO2亅 偺旝検掕検梡丄崅姶搙丄侽丏侽俀乣侽丏俀倫倫倣偱 媧岝搙偑捈慄偲側傞丅
丂丂丒丂僽儖僔儞丒俈悈榓暔丂侾丏俀俉係倗/侾侽侽倣倢悈梟塼丂丒丒丒丂擹俫2俽俷4偲嫟偵梡偄偰 NO3亅 偺斾怓掕検梡丄侽丏侾乣俀丏俆倫倫倣偱捈慄丄丂夁墫慺巁乮HClO4乯傪壛偊傞偲 NO2亅傕掕検壜擻偲側傞丅
丂丂丂

丂

丂丂乮俁乯丂梲僀僆儞暘愅梡 崿崌帋椏塼偺嶌惉丗丂慡晹崿偤傞偲戝曄側偺偱丄師偺係偮偵暘偗傞偙偲偵偟偨丅丂偦傟偧傟偺梲僀僆儞偼 侽丏侽侾乣侽丏侽俆M偺斖埻撪偲偟偨丅
丂丂仠丂嘥塼丗丂俙倗2亄丄俠倳2亄丄俹倐2亄丄俛倝3亄丂丒丒丒丂戞侾懏丄戞俀懏俙丂乮徤巁墫乯
丂丂丒丂AgNO3丂侽丏俇倗乮亖侽丏侽侽係倣倧倢乯/侾侽倣倢丂亖侽丏係俵丄丂丂丒丂俹倐丂侾倗乮侽丏俉倗亖侽丏侽侽係倣倧倢乯丂亄丂擹俫俶俷3丂侾丏俀倣倢 偵梟偐偡乮斀墳偟偵偔偄偺偱壛擬丒幭暒丅丂斀墳屻丄亄庒姳偺悈乯丄丂丂丒丂俛倝丂侾丏俆倗乮侾丏侾倗亖侽丏侽侽係倣倧倢乯丂亄丂擹俫俶俷3丂侾丏俀倣倢 偵梟偐偡丄丂丂丒丂俠倳俷乮俵亖俈俋丏俆乯丂侽丏係倗乮侽丏侽侽係倣倧倢乯丂亄丂擹俫俶俷3丂侽丏俇倣倢 亄 悈偱 栺俀倣倢偵偟偨傕偺偵梟偐偡乮彮偟壛擬乯丄
丂丂埲忋偺係庬偺忋悷傒傪崿崌偟丄慡懱傪悈偱 侾侽侽倣倢偲偟丄偝傜偵 侾丏俆攞偵敄傔傞丅師徤巁價僗儅僗乮晄梟惈乯偑懡検偵捑揳偡傞偺偱丄俁侽倣倢偩偗 傠夁偡傞丅 嵟屻偵 俇俵 俫NO3丂俀揌傪壛偊傞丅丂丒丒丒丒丂奺栺侽丏侽俀俇俵乮Bi 偼嬐彮乯丄丂寁俁侽倣倢
丂丂仠丂嘦塼丗丂俠倓2亄丄俥倕3亄丄倅値2亄丄俶倝2亄丂丒丒丒丂戞俀懏俙丄戞俁懏丄戞係懏丂乮墫壔暔丄棸巁墫崿崌丄丂摿偵 Cd偲 Zn偺暘棧偑億僀儞僩乯
丂丂丒丂俠倓俠倢2丒俀丒侾/俀 H2O乮M亖俀俀俉丏俁乯丂侽丏俀倗乮侽丏侽侽侾倣倧倢乯/俁侽倣倢悈梟塼偲偡傞丄偙傟偵丄丂丂丒丂倅値俽俷4丒俈俫2俷乮俵亖俀俉俈丏俆乯丂侽丏俁倗丄丂丒丂俥倕俶俫4乮俽俷4乯2丒侾俀俫2俷乮俵亖係俉俀丏俀乯丂侽丏俆倗丄丂丒丂俶倝俠倢2丒俇俫2俷乮俵亖俀俁俈丏俈乯丂侽丏俀倗丂傪壛偊偰 傛偔奾漚偡傞丅 嵟屻偵 俇俵 俫俠倢丂堦揌傪壛偊偰偍偔丅丂丂丒丒丒丒丂奺栺侽丏侽俁俵丄丂寁俁侽倣倢
丂丂仠丂嘨塼丗丂俥倕3亄丄俵値2亄丄俙倢3亄丄俠倰3亄丂丒丒丒丂戞俁懏丂乮H2S傪巊梡偟側偄乯
丂丂丒丂俥倕俶俫4乮俽俷4乯2丒侾俀俫2俷乮俵亖係俉俀丏俀乯丂侽丏俆倗丄丂丂丒丂俵値俠倢2丒係俫2俷乮俵亖侾俋俉乯丂侽丏俀倗丄丂丂丒丂俙倢俲乮俽俷4乯2丒侾俀俫2俷乮俵亖係俈係丏係乯丂侽丏俆倗丄丂丒丂俠倰2乮俽俷4乯3丒倶俫2俷乮倶佮侾俀丄俵亖俈侾俇丏俆乯丂侽丏俈倗丂傪丄悈偵壛偊偰 俁侽倣倢偲偟丄傠夁偡傞丅 嵟屻偵 俇俵 俫俠倢丂俆揌傪壛偊傞丅丂丒丒丒丒丂奺栺侽丏侽俁俵丄丂寁俁侽倣倢
丂丂仠丂嘩塼丗丂俶倝2亄丄俠倎2亄丄俽倰2亄丄俛倎2亄丂丒丒丒丂戞係懏丄戞俆懏丂乮H2S傪巊梡偟側偄乯
丂丂丒丂俶倝俠倢2丒俇俫2俷乮俵亖俀俁俈丏俈乯丂侽丏俀倗丄丂丒丂俠倎俠倢2乮俵亖侾侾侾乯丂侽丏侾倗丄丂丒丂俽倰乮俶俷3乯2乮俵亖俀侾侾丏俇乯丂侽丏俀倗丄丂丒丂俛倎俠倢2丒俀俫2俷乮俵亖俀係係丏俁乯丂侽丏俀俆倗丂傪丄悈偵壛偊偰 俁侽倣倢偲偡傞丅丂嵟屻偵 俇俵 俫俠倢丂俀揌傪壛偊傞丅丂丒丒丒丒丂奺栺侽丏侽俁俵丄丂寁俁侽倣倢
丂丂乮偽偭婥偲 傠夁偺曽朄乯
丂丂丒丂暘愅杮斣偱丄彫帋尡娗偵捠偡帪偼丄僥僌僗偱捿偭偰 庢傝弌偟傗偡偄傛偆偵偟偰偍偔丅乮僥僼儘儞僥乕僾偼堷偭妡偐傝乯
丂丂丒丂捑揳暔傪梟偐偟偰嵦庢偡傞応崌偼 傠夁娗乮姡憞娗傪揮梡乯傪梡偄丄扙帀柸傪媗傔 僽儘傾傪墴偟摉偰偰梡偄傞丅乮捑揳偑嵶偐偔扙帀柸傪捠傝敳偗傞偲偒偵偼 彫僾儔楻搇偲傠巻傪巊梡偡傞丅帪娫偑偐偐傞丅乯
丂丂丒丂忲敪擹弅丒姡屌側偳偺帪偼 擬僔儑僢僋偵嫮偄 愇塸傞偮傏乮侾侽們們丄俁侽們們丄 傾儕僄僋乯偑巊偄傗偡偄丅
丂

丂丂俀丏丂梲僀僆儞偺宯摑暘愅丗
丂丂乮侾乯丂帋椏塼 嘥 偺暘愅丗丂丂丒丒丒丂戞侾懏丄戞俀懏A丂丂丂丂宯摑暘愅僼儘乕
丂丂帋椏塼 嘥 傪丄俀倣倢暘庢偟丄偦傟偵崌傢偣偰巊梡偡傞帋尡娗偼 彫帋尡娗乮冇侾係亊俋俆倣倣乯傪梡偄偨丅
丂丂戞侾懏偼丄HC倢偱捑揳偡傞傕偺偱丄俇M HCl 俀揌壛偊傞偲丄俙倗俠倢丄俹倐俠倢2丄俫倗2俠倢2偑捑揳偡傞丅 寉偔壛擬偟偰捑揳弉惉偟丄傛偔椻媝偝偣丄P倐俠倢2傪側傞傋偔棊偲偡丅偝傜偵俇M HCl 俀揌壛偊丄偙傟埲忋捑揳偑惗惉偟側偄偙偲傪妋擣偡傞丅丂傠夁娗偵傛傞傠夁傪峴側偆丅丂仺丂傠塼偼 戞俀懏傊丅偨偩偟丄傠塼偵偼傑偩梟偗偰偄傞P倐俠倢2傪娷傓丅
丂丂擬搾偱丄俹倐俠倢2傪暿偺帋尡娗偵愻偄棊偲偡丅丂仺丂恷巁傾儞儌僯僂儉丄K2CrO4 傪壛偊傞偲 PbCrO4乮僋儘儉巁墧乯偺 墿怓捑揳丅
丂丂偝傜偵丄偦偺傑傑摨偠傠夁娗傪 暿偺帋尡娗偵嵎偟懼偊丄俇俵 俶俫3傪侾侽揌揌壓偡傞偲丄俙倗俠倢偑嶖僀僆儞偲側偭偰棊偪傞丅 僼僃僲乕儖僼僞儗僀儞堦揌偲 侾N 俫俠倢傪壛偊偰柍怓偲偟丄嵞傃俙倗俠倢偺敀怓捑揳偑尒傜傟傞丅 俲俬乮儓僂壔僇儕僂儉乯傪擖傟傞偲 儓僂壔嬧偺墿敀怓偺捑揳丅 NaOH偲儂儖儅儕儞偱 奃崟怓偺嬥懏嬧偵側傞丅

丂丂戞俀懏偼丄倫俫侽丏俆乣侽丏俈偺嫮巁惈偱 俫2俽 偵傛偭偰棸壔暔傪捑揳偡傞傕偺偱丄 俹倐俽丄俠倳俽丄俛倝2俽3 偑捑揳偡傞丅棸壔悈慺偺検偼彮側偔偰傛偔乮FeS 俆倗偔傜偄偱廩暘乯丄彮偟捠偡偩偗偱懍傗偐偵丄姰慡偵捑揳偡傞丅
丂丂偙偙偱偼丄戞俁懏埲崀偺僀僆儞傪娷傑側偄偙偲偑暘偐偭偰偄傞偺偱丄戞侾懏偐傜偺傠塼偵丄偦偺傑傑 俫2俽傪捠偠偰捑揳偝偣偨丅姺婥拲堄
丂丂偙傟傪丄傠夁偡傞偙偲側偟偵 俇俵 俫俶俷3傪俀乣俁倣倢壛偊偰幭暒偟丄捑揳傪暘夝偡傞丅 偝傜偵侾侽倣倢偺愇塸傞偮傏乮忲敪嶮傛傝傕擬僔儑僢僋偵嫮偄乯偵擖傟偰 俇俵 俫俶俷3傪 俉揌壛偊丄忲敪姡屌偟偰偝傜偵壛擬偟偰 俽俷3偺敀墝傪弌偝偣傞丅 偙傟偵 俁俵 俫2俽俷4 俀揌偲 悈俀倣倢壛偊傞偲丄俠倳丄俛倝偼棸巁墫偲偟偰梟偗偰丄俹倐俽俷4偼敀怓暡枛偲偟偰巆傞丅
丂丂偙傟傪傠夁偟丄傠塼偵 擹俶俫3傪壛偊傞偲丄俠倳偼嶖僀僆儞偲偟偰梟偗丄俛倝偼 俛倝(俷俫)3偲偟偰敀偄捑揳偑偱偒傞偑丄検偑彮側偐偭偨偺偱俛倝偺妋擣偼庢傝傗傔偲偟偨丅乮帋椏塼嶌惉偺偲偙傠偱戝晹暘偑幐傢傟偨乯丂忋悷傒傪僼僃僲乕儖僼僞儗僀儞亄恷巁偱拞榓偟偰 俲4俥倕(俠俶)6堦揌擖傟傞偲丄僼僃儘僔傾儞壔摵偺 愒妼怓捑揳偑偱偒傞丅
丂丂傠夁娗偵巆偭偨俹倐俽俷4偼丄侾俵 恷巁傾儞儌僯僂儉傪揌壓偡傞偲梟偗偰棊偪傞丅 俲2俠倰俷4偱 俹倐俠倰俷4偺 墿怓捑揳丅
丂丂

丂丂乮俀乯丂帋椏塼 嘦 偺暘愅丗丂丂丒丒丒丂戞俀懏A丄戞俁懏丄戞係懏丂丂丂宯摑暘愅僼儘乕
丂丂帋椏塼 嘦 傪丄俀倣倢暘庢丅丂偙偙偱偼丄戞俀懏偲戞係懏偺 倫H挷惍偵傛傞H2S捑揳暘棧偑 廳梫側億僀儞僩偲側傞丅
丂丂戞俀懏偼丄俫2俽敇婥偺嵺丄CdS偺傒捑揳偟 ZnS偼梟塼偵偲偳傑傞傛偆偵丄倫H傪 侽丏俆乣侽丏俉掱搙偵挷惍偡傞丅
丂丂僠儌乕儖僽儖乕乮TB乯堦揌傪壛偊丄侾M HCl 傪揌壓丒奾漚偟 倫H亖侾丏俆乣侾丏俀乮墿怓枴偑姰慡偵徚偊丄僺儞僋愒怓乯偵側偭偨傜丄偦偙偐傜 侾M HCl傪 侾侽揌壛偊傞丅丂乮僸慺As乮嘪乯偑娷傑傟偰偄傞偲偒偼丄NH係I 傪壛偊偰壛擬偟丄As乮嘨乯偵娨尦偟偰偍偔丅乯
丂丂偽偭婥憰抲偵僙僢僩偟俫2俽傪捠偡丅乮CdS偺墿乣墿烌怓捑揳乯姺婥拲堄丂捑揳傪傠夁娗偱傠夁偟丄侽丏侾M HCl丒H2S朞榓塼 俁倣倢偱捑揳傪愻忩偡傞丅丂仺丂傠塼偼丄戞俁懏傊丅
丂丂乮Na2Sx丄壛壏丄捑揳暘棧偼丄戞俀懏B偑娷傑傟偰偄側偄偺偱徣棯乯
丂丂嵶偄朹偱柸傪墴偟弌偟丄晅拝偟偰偄傞捑揳傪 悈俀倣倢偱愇塸傞偮傏偵愻偄棊偲偡丅丂俇M HNO3 俀倣倢壛偊丄幭暒屻丄俇M HNO3 俉揌壛偊偰 忲敪姡屌丄偝傜偵壛擬偟偰SO3偺敀墝傪弌偡丅 俁M H2SO4 俀揌亄悈俀倣倢壛偊偰梟偐偡丅丂乮偙偙偱偼丄晄梟惈偺俹倐俽俷4偼巆傜側偄乯
丂丂梟塼偵 擹俶俫3傪俀揌壛偊乮偙偙偱偼丄俛倝乮俷俫乯3偼捑揳偟側偄乯丄侾俵 俲俠俶傪俀揌壛偊乮俠倳偑偁傞応崌丄俫2俽偱俠倳俽偼捑揳偟側偄乯丄偝傜偵 俫2俽傪捠偡丅姺婥拲堄丂俠倓俽偺墿怓捑揳丅乮Cd偺妋擣乯
丂丂丂

丂丂戞俁懏偼丄倫H亖俉乣俋丏俆偱 NH3偱悈巁壔暔偺捑揳傪宍惉偡傞傕偺偱丄戞係懏偼傾儞儈儞嶖懱偲偟偰傠塼偺曽傊峴偔丅
丂丂愭偺傠塼傪俁侽倣倢愇塸傞偮傏偱幭暒偟偰 俫2俽傪捛偄弌偟丄徤巁墧傠巻偵堦揌偮偗偰 俫2俽偑懚嵼偟側偄偙偲傪妋擣偡傞丅 僼僃僲乕儖儗僢僪堦揌亄朞榓NH4Cl俀揌傪壛偊偰丄擹NH3偱 愒仺墿乮倫H亖俉丏係乯偵側偭偨傜 偝傜偵擹俶俫3 俁揌壛偊偰乮倫H亖俉丏侽乣俋丏俆丄丂Ni丄Co丄Zn偼傾儞儈儞嶖懱梟丄戞俆懏偼悈巁壔暔傪捑揳偟側偄乯壛壏偟丄朞榓廘慺悈乮俛倰丄 俥倕乮嘦乯仺俥倕乮嘨乯丄 俵値乮嘦乯仺俵値乮嘨丄嘩乯偵巁壔乯侾侽揌壛偊偰 悢暘娫壛壏偡傞丅
丂丂偙傟傪傠夁娗偱傠夁偟丄捑揳暔乮偙偙偱偼Fe乮OH乯3乯傪丄朞榓NH4Cl 俀揌亄俇M NH3 俀揌亄悈係倣倢 偱愻忩偡傞丅丂扙帀柸傪偄偔傜偐捠傞偺偱 傕偆堦搙捠忢傠夁偡傞丅丂仺丂傠塼偼丄戞係懏傊丅
丂丂嵶偄朹偱柸傪墴偟弌偟丄晅拝偟偰偄傞捑揳傪 悈俀倣倢偱愇塸傞偮傏偵愻偄棊偲偡丅丂俇M NaOH 侾侽揌丄俁亾H2O2 俀侽揌傪壛偊 幭暒丒奾漚偟丄捠忢傠夁偱傠夁偡傞丅乮傠塼偵偼Al(OH)4亅丄CrO42亅偼柍偄乯丂捑揳傪 俇M HNO3 侾侽揌丄悈俀倣倢偱愻偄棊偲偟丄俆亾墫巁僸僪儘僉僔儖傾儈儞俀揌傪壛偊偰幭暒偡傞丅乮Fe(OH)3仺Fe(嘨)丄Mn(OH)n仺Mn(嘦)乯丂梟塼傪擇偮偵暘偗丄堦曽偵 侽丏侾M KSCN堦揌丂仺丂愒怓捑揳乮Fe(嘨)偺妋擣嘆乯丄 傕偆堦曽偵丄侽丏侽俀俆M K4Fe(CN)6 堦揌丂仺丂惵怓捑揳乮Fe(嘨)偺妋擣嘇乯
丂

丂丂戞係懏偼丄H2S偵傛偭偰 倫H亖俀丏俇慜屻偱 棸壔暔傪捑揳偡傞 倅値偲丄傾儖僇儕惈偵偟偰乮NH4乯2S偱捑揳偡傞 Ni丄Co偑偁傞丅
丂丂愭偺傠塼傪 俁侽倣倢愇塸傞偮傏偵擖傟丄壛擬偟傎傏忲敪姡屌乮俶俫3彍嫀乯偟丄曻椻屻丄悈係倣倢丄俇M恷巁 係揌偵梟偐偟乮侽丏俁M恷巁巁惈梟塼偺 倫俫亖俀丏俇偱 倅値俽乮懷墿敀怓乯偼偡傋偰捑揳偟丄俶倝俽丄俠倧俽乮崟怓乯偼捑揳偟側偄乯丄俫2俽敇婥偟丄搾梺拞偱俀乣俁暘壛擬偟丄捠忢傠夁偡傞丅姺婥拲堄丂偙傟傪 悈俀倣倢亄朞榓NH4Cl偱愻忩偟乮偙偺愻塼晄梫乯丄敀怓捑揳暔偺 ZnS 偑巆傞偺偱丄侾M HC倢 侾侽揌偲 傠夁娗偛偲壛壏偟偰 悈俀倣倢壛偊偰棊偲偡丅丂俲3俥倕(俠俶)6乮僼僃儕僔傾儞壔僇儕僂儉丄巁壔嵻乯 堦揌偲 俶俶乚僕僄僠儖傾僯儕儞堦揌傪壛偊傞丂仺丂烌愒怓偺捑揳 乮倅値偺妋擣乯
丂丂愭偺傠塼偵丄擹NH3 俀揌壛偊丄俁亅係暘壛壏偟丄侽丏俆M (NH4)2S 俀揌壛偊丄傠夁娗偱傠夁偡傞丅傠塼偵偝傜偵侽丏俆M (NH4)2S 俀揌壛偊丄傕偆堦搙栠偟偰捑揳暘棧偡傞丅乮捑揳偼崟怓偺 俶倝俽丄俠倧俽乯丂悈俀倣倢亄朞榓俶俫4俠倢 偱愻忩偡傞丅丂乮傠塼偼丄戞俆懏偑柍偄偺偱 偙偙偱廔椆乯
丂丂扙帀柸偛偲捑揳傪俁侽倣倢愇塸傞偮傏偵擖傟丄俇M HC倢 係揌丄俆亾NaClO 侾侽揌傪擖傟偰乮柸傪峣傝乯 忲敪丒傎傏姡屌偟丄悈俀倣倢壛偊傞丅 梟塼偵丄俇M NH3 係揌丄僕儊僠儖僌儕僆僉僔儉俀揌丂仺丂僺儞僋愒怓捑揳 乮俶倝偺妋擣乯
